Медицинская энциклопедия - осмотическое давление
Осмотическое давление
Осмотическое давление — давление на раствор, отделенный от чистого растворителя мембраной, проницаемой только для молекул растворителя (полупроницаемая мембрана), при котором прекращается осмос. Осмосом называют самопроизвольное проникновение (диффузия) молекул растворителя через полупроницаемую мембрану в раствор или из раствора с более низкой концентрацией в раствор с более высокой концентрацией.
Измерение осмотического давления производят при помощи осмометров. Схема простейшего осмометра показана на рисунке.
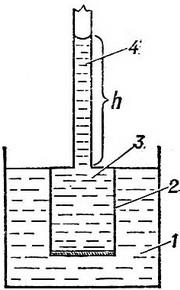 Схема осмометра: 1— вода; 2 — целлофановый мешочек (полупроницаемый); 3 — раствор; 4 — стеклянная трубка; h — высота столбика жидкости (мера осмотического давления). |
В качестве полупроницаемых мембран применяют пленки из целлофана, коллодия и др.
Осмотическое давление разбавленных растворов неэлектролитов при постоянной температуре пропорционально молярной концентрации раствора, а при постоянной концентрации — абсолютной температуре. Растворы, обладающие равными осмотическим давлением, называют изотоническими. Раствор с большим осмотическим давлением называют гипертоническим, а с меньшим — гипотоническим.
Осмос и осмотическое давление играют большую роль в обмене воды между клетками и окружающей их средой. Осмотическое давление крови человека в норме в среднем равно 7,7 атм и определяется суммарной концентрацией всех веществ, растворенных в плазме. Часть осмотического давления крови, определяемая концентрацией белков плазмы и равная в норме 0,03— 0,04 атм, называется онкотическим давлением. Онкотическое давление играет существенную роль в распределении воды между кровью и лимфой.
См. также Диализ, Изотонические растворы. Электролиты.
Осмотическое давление — это внешнее давление на раствор, отделенный от чистого растворителя полупроницаемой мембраной, при котором прекращается осмос. Осмосом называют одностороннюю диффузию растворителя в раствор через разделяющую их полупроницаемую мембрану (пергамент, животный пузырь, пленки из коллодия, целлофана). Мембраны такого рода проницаемы для растворителя, но не пропускают растворенные вещества. Осмос наблюдают и в том случае, когда полупроницаемая мембрана разделяет два раствора с разными концентрациями, при этом растворитель перемещается через мембрану от раствора менее концентрированного к раствору более концентрированному. Величина осмотического давления раствора определяется концентрацией в нем кинетически активных частичек (молекул, ионов, коллоидных частиц).
Измерение О. д. производят при помощи приборов, называемых осмометрами. Схема простейшего осмометра представлена на рис. Заполненный исследуемым раствором сосуд 1, дно которого представляет собой полупроницаемую мембрану, погружают в сосуд 2 с чистым растворителем. Вследствие осмоса растворитель будет переходить в сосуд 1 до тех пор, пока избыточное гидростатическое давление, измеряемое столбиком жидкости высотой h, достигнет величины, при к рой осмос прекращается. При этом между раствором и растворителем устанавливается осмотическое равновесие, характеризующееся равенством скоростей прохождения молекул растворителя через полупроницаемую мембрану в раствор и молекул раствора в растворитель. Избыточное гидростатическое давление столбика жидкости высотой h является мерой О. д. раствора. Определение О. д. растворов часто производят косвенным методом, например измерением понижения температуры замерзания растворов (см. Криометрия). Этот метод широко применяют для определения О. д. крови, плазмы крови, лимфы, мочи.
Осмотическое давление изолированных клеток измеряют методом плазмолиза. Для этого исследуемые клетки помещают в растворы с разными концентрациями какого-либо растворенного вещества, для которого клеточная оболочка непроницаема. Растворы с О. д. большим, чем О. д. содержимого клеток (гипертонические растворы), вызывают сморщивание клеток (плазмолиз) вследствие выхода воды из клетки, растворы
с О. д. более низким, чем О. д. содержимого клетки (гипотонические растворы), вызывают разбухание клеток в результате перехода воды из растворов в клетку. Раствор с О. д., равным О. д. содержимого клеток — изотонический (см. Изотонические растворы), не производит изменения объема клетки. Зная концентрацию такого раствора, О. д. содержимого клетки вычисляют по уравнению (1).
О. д. разбавленных растворов неэлектролитов следует законам, установленным для давления газов, и может быть вычислено но уравнению Вант-Гоффа:
п=сRT, (1)
где п — осмотическое давление, с — концентрация раствора (в молях на 1 л раствора), Т— температура по абсолютной шкале, R— постоянная (0,08205 л·атм/град·моль).
О. д. раствора электролита больше О. д. раствора неэлектролита той же молярной концентрации. Это объясняется диссоциацией молекул растворенного электролита на ионы, вследствие чего возрастает концентрация кинетически активных частиц в растворе. О. д. для разбавленных растворов электролитов вычисляется по уравнению:
где i — изотонический коэффициент, показывающий, во сколько раз О. д. раствора электролита больше О. д. раствора неэлектролита той же молярной концентрации.
Общее О. д. крови человека в норме равно 7—8 атм. Часть О. д. крови, обусловленная содержащимися в ней высокомолекулярными веществами (в основном белками плазмы крови), называется онкотическим, или коллоидно-осмотическим давлением крови, которое в норме равно 0,03—0,04 атм. Несмотря на малую величину, онкотическое давление играет важную роль в регуляции водного обмена между кровеносной системой и тканями. Измерение О. д. находит широкое применение для определения молекулярного веса биологически важных высокомолекулярных веществ, например белков. Осмос и осмотическое давление играют большую роль в процессах осморегуляции, т. е. поддержания осмотической концентрации растворенных веществ в жидкостях организма на определенном уровне. При введении различного рода жидкостей в кровь и в межклеточное пространство наименьшее нарушение в организме вызывают изотонические растворы, т. е. растворы, О. д. которых равно О. д. жидкости организма. См. также Проницаемость.

См. в других словарях

Вопрос-ответ:
Самые популярные термины
1 | 16524 | |
2 | 13800 | |
3 | 11693 | |
4 | 10153 | |
5 | 9313 | |
6 | 8772 | |
7 | 8081 | |
8 | 7755 | |
9 | 7310 | |
10 | 7265 | |
11 | 6552 | |
12 | 6538 | |
13 | 6440 | |
14 | 6345 | |
15 | 5889 | |
16 | 5551 | |
17 | 5391 | |
18 | 5142 | |
19 | 4968 | |
20 | 4966 |










